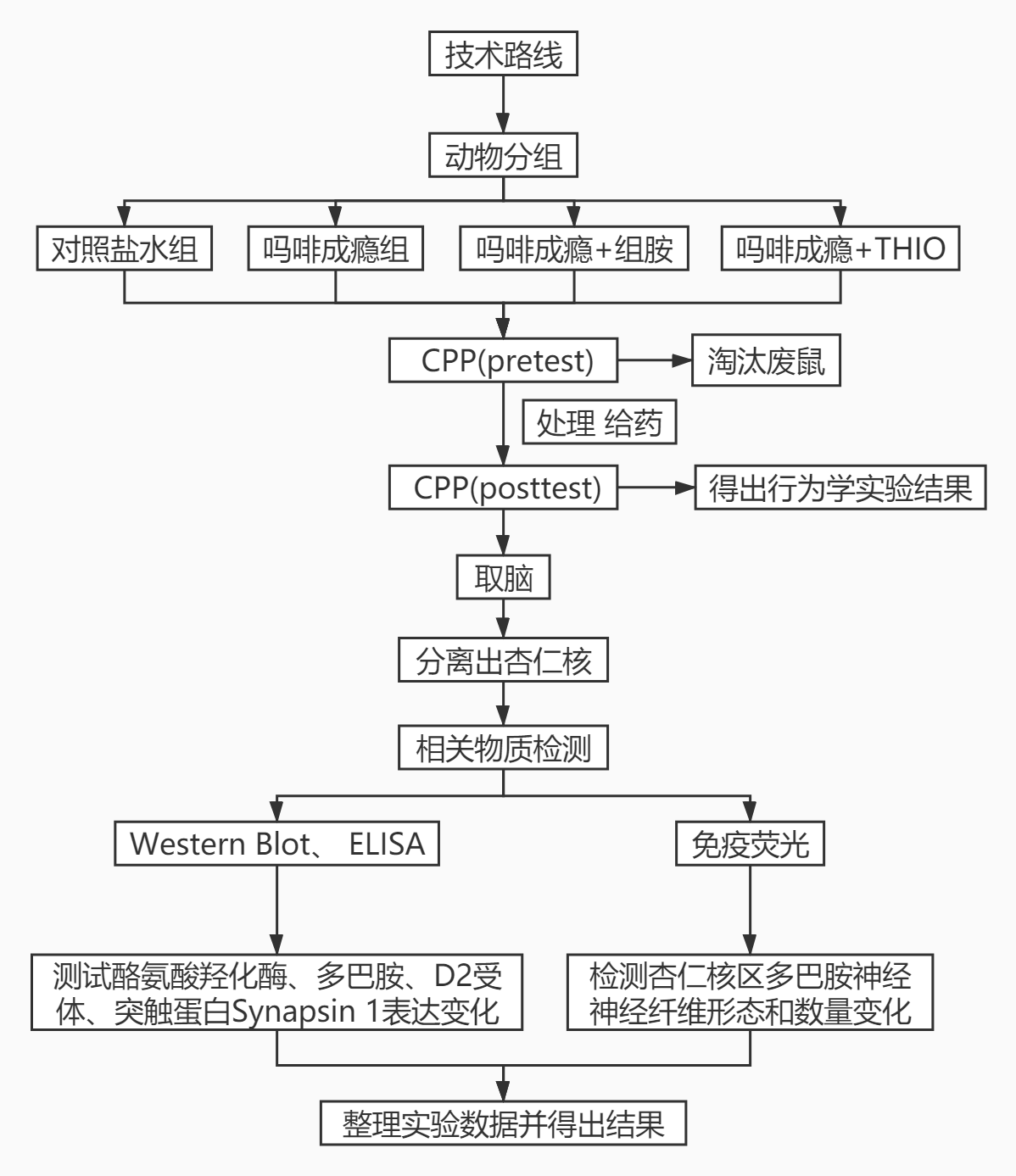
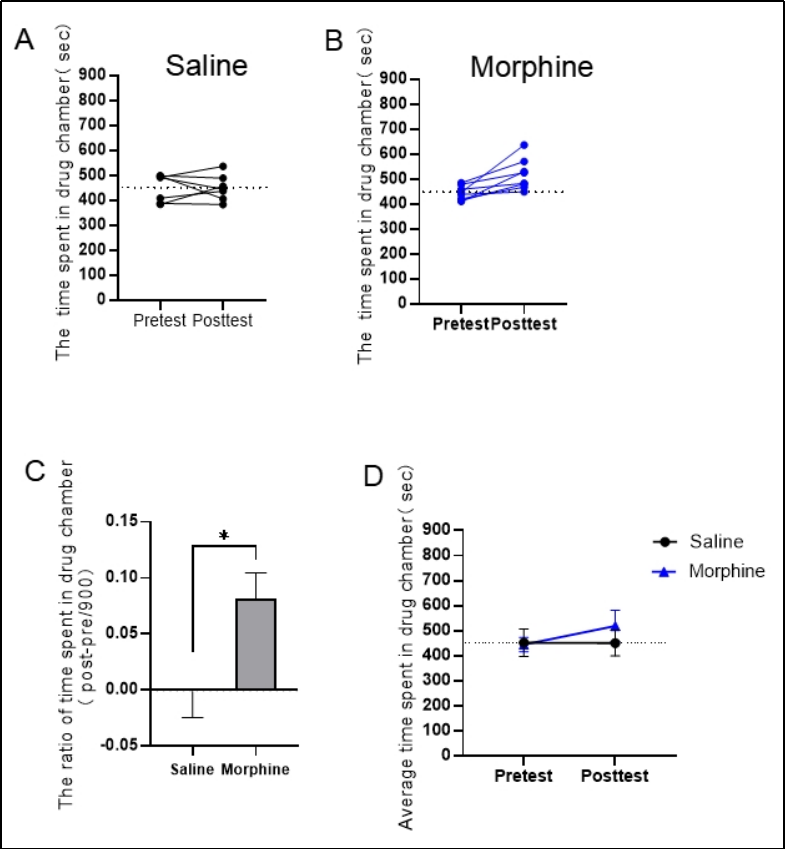
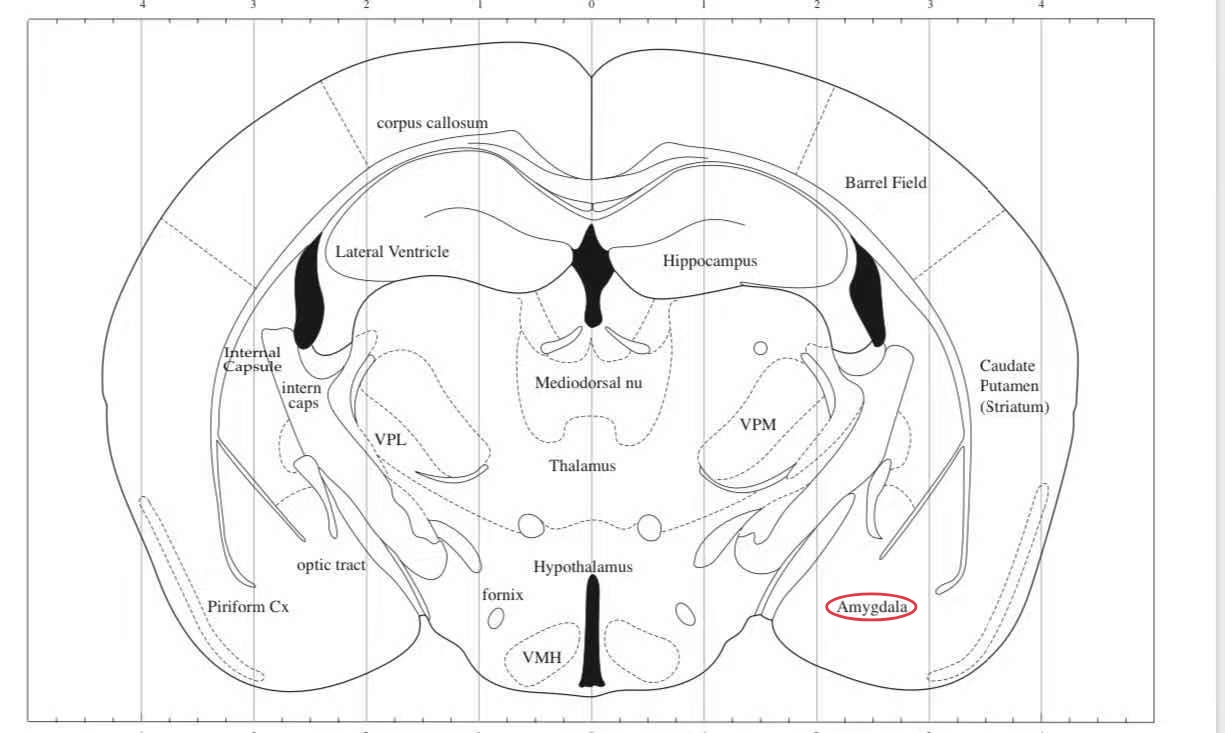
吗啡等阿片类药物是一类强效镇痛剂,对手术或创伤后急性中重度疼痛、癌痛尤其有效。但是阿片类药物也带来很多问题,如耐受、痛觉过敏、呼吸抑制、成瘾等,其中阿片类药物成瘾发生率高,对个人、家庭及社会的危害极大。阿片类药物成瘾过程中伴随着相应受体、神经递质、信号通路、基因表达以及突触可塑性等方面的变化。目前对于阿片成瘾的研究主要集中于其躯体依赖性和精神依赖性。而大脑中的杏仁核不仅和痛觉本身有关,还参与吗啡的镇痛作用,若损毁动物单侧杏仁核,足底注射福尔马林引起疼痛后,吗啡在损毁同侧的镇痛作用消失;损毁单侧的中央杏仁核及基底外侧核,吗啡在损毁同侧的镇痛作用减弱,而在损毁对侧的镇痛作用不受影响[1,2]。而一些研究者发现条件性诱发复吸与泛杏仁核(extended amygdala,包括杏仁核中央核、Nac壳部、终纹底核)和它与基底外侧杏仁核(basolateral amygdala,BLA)、中脑DA系统的传入通路有关[3]。杏仁核与Nac共同参与药物线索介导的复吸。杏仁核作为边缘系统的皮质下中枢,在疼痛调制过程中起了关键作用,尤其是中央杏仁核(central amygdala,CeA),它又被称为“伤害感受性杏仁核”,具有强烈的感觉和情感维度。神经递质、神经肽、激素及相应受体参与杏仁核的疼痛调控[4]。在杏仁核众多的神经核团中,中央杏仁核(CeA)参与觉醒、情感表达以及环境刺激与情感状态的形成。条件位置偏爱(CPP)的研究提出杏仁核在药物滥用导致的奖赏刺激中起着重要的作用[5]。在解剖位置上,杏仁核联结着伏隔核(Nac)、并且接受来自中脑腹侧被盖区(VTA)高密度的多巴胺传入纤维和来自下丘脑后部的乳头核(TM )的组胺传入神经纤维[2]。多巴胺神经纤维、组胺神经纤维以及胆碱等神经纤维在杏仁核中共存,这为中枢组胺(作为一种神经调质)与多巴胺、胆碱等多种神经纤维的相互作用提供了又一个解剖学的依据。前期研究指出杏仁核的多巴胺D2受体(D2R)介导了VTA-CeA通路[6,10],通过检测多巴胺D2受体(D2R)的数量从而反映VTA-CeA通路中多巴胺神经纤维的数量。
组胺是中枢神经系统中一种重要的神经递质或神经调质。组胺具有H1、H2、H3和H4四种受体,研究发现组胺H3受体(histamine H3 receptor, H3R)最为特别,它是一种自身受体,分布于组胺能神经元的胞体、树突、轴突以及其他一些神经元的轴突上,可以负反馈抑制组胺或其他神经递质的合成和释放。同时组胺H3R是G蛋白偶联受体家族的成员,能够通过激活下游多条蛋白通路发挥多种生理功能。有研究报道称组胺H3R可通过组胺非依赖性的途径加重缺血导致的脑损伤,而H3R拮抗剂可以在动物脑缺血时发挥神经保护作用[7]。噻普酰胺( thioperamide,THIO)是第1个强效选择性H3受体拮抗剂,其与rH3受体具有较强的亲和力(pKi= 8.4),与hH3受体亲和力相对较弱(pKi =7.2)[8]但随后发现其与hH4 受体(pKi=7.3)、大鼠5-HT3(pKi=5.6)受体等其他受体也有较大的亲和性。现在THIO常作为典型的 H3 受体拮抗剂用于研究H3受体在体内的多种生物学作用[9]。组胺H3R受体拮抗剂对吗啡成瘾小鼠杏仁核中多巴胺神经纤维的影响及对精神依赖的作用未见报道,相关分子机制仍待研究,而之前研究发现,戒断成瘾药物后所产生的痛苦与激活脑内另一个脑区杏仁核多巴胺系统有关,如果用THIO作用于组胺H3受体对杏仁核多巴胺系统进行干预,对减少“药物成瘾者”因环境因素导致的“药物复吸”顽症有重要临床意义。
[1] Volkow ND, Michaelides M, Baler R. The Neuroscience of Drug Reward and Addiction. Physiol Rev. 2019;99(4):2115-2140. doi:10.1152/physrev.00014.2018
[2] Elman I, Borsook D.Common Brain Mechanisms of Chronic Pain and Addiction. Neuron. 2016 Jan 6;89(1):11-36.
[3]Rizzo MR, Fasano R, Paolisso G. Adiponectin and Cognitive Decline. Int J Mol Sci. 2020;21(6):2010. Published 2020 Mar 16.
[4] Beltrán-Campos V, Silva-Vera M, García-Campos ML, Díaz-Cintra S.Effects of morphine on brain plasticity. Neurologia. 2015 Apr;30(3):176-80.
[5] RezayofA, Zarrind astMR, Sah raeiH et al. Imvolvement of dopamin e D2-receptors of the central amygdala on the acquisition and expression of morphine-induced place p reference in rat[J]. Pharmacol Biochem Behav, 2002, 74(1):187 -97.
[6] Jiaojiao Song,Ming Chen,Yi Dong,et al.Chronic morphine selectively sensitizes the effect of D1 receptor agonist on presynaptic glutamate release in basolateral amygdala neurons that project to prelimbic cortex. Neuropharmacology. 2018 05 01;133: 375-384.
[7]Yan H, Zhang X, Hu W, et al. Histamine H3 receptors aggravate cerebral ischaemic injury by histamine-independent mechanisms [J].Nat Commun, 2014, 5:3334.
[8]Lovenberg TW,Pyati J,Chang H,et al. Cloning of rat histamine H3 receptor reveals distinct species pharmacological profiles[J].J Pharmacol Exp Ther,2000,293(3) : 771-778.
[9]Zavros Y,Mesiwala N,Waghray M,et al. Histamine 3 receptoractivation mediates inhibition of acid secretion during Helicobact- er-induced gastritis [J]. World J Gastrointest Pathophysiol,2010,1( 5) : 154-165.
[10]Yingqi Wang,Yan Pan,Zhangyin Cai, et al.Inputs from paraventricular nucleus of thalamus and locus coeruleus contribute to the activation of central nucleus of amygdala during context-induced retrieval of morphine withdrawal memory. Exp Neurol. 2021 Apr ;338: 113600.