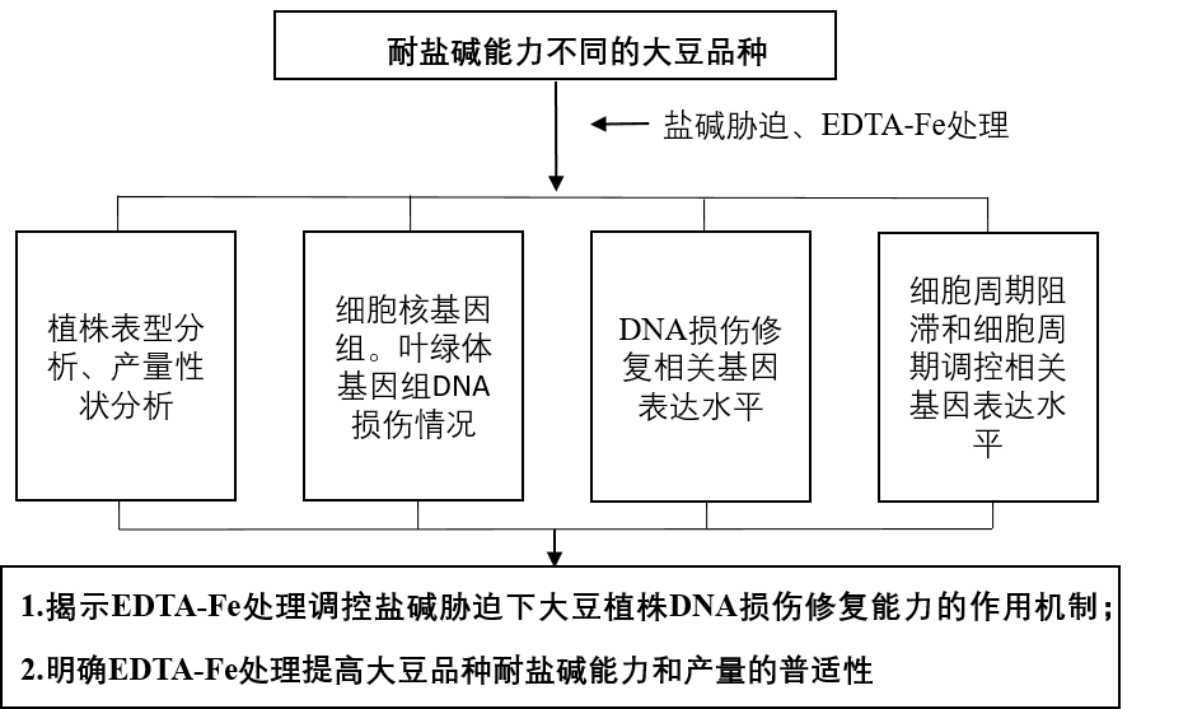
1.盐碱胁迫引起的DNA损伤
盐碱环境中存在的高浓度中性盐(NaCl、Na2SO4)和碱性盐(NaHCO3、Na2CO3)能够对植物造成氧化胁迫、渗透胁迫、营养胁迫、离子毒害、高pH值胁迫等,抑制植物的生长,甚至导致死亡[1-3]。盐碱胁迫对植物最常见的影响包括抑制种子的萌发、降低植株生物量、导致叶片枯黄衰亡、籽粒产量和品质下降等[1-4]
活性氧(Reactive oxygen species,ROS)是植物有氧代谢的副产物,但也是参与调控植物生长发育及各种胁迫反应的重要信号分子。盐碱等非生物胁迫能够诱导植物叶绿体、线粒体、质膜、过氧化物酶体和内质网等细胞器内产生大量ROS累积,引起氧化应激反应。过量的ROS会破坏DNA碳水化合物基团、嘌呤、嘧啶碱基和磷酸二酯键的结构,导致各种类型的DNA损伤,包括染色体断裂、链间和链内交联以及单碱基突变[5]。ROS诱导细胞核或线粒体DNA氧化损伤的产物为8-羟基-2-脱氧鸟嘌呤(8-OH-dG)[6],而8-羟基鸟苷(8-OHG)负责RNA的氧化修饰[7]。8-OH-dG是DNA氧化损伤的关键生物标志物。生物医学研究表明,8-OH-dG与突变和癌基因表达有关[8]。8-OH-dG可抑制mRNA表达,降低编码蛋白水平。另一种常见的DNA氧化损伤是无尿嘧啶/无嘧啶(AP或碱性)位点出现[9]。AP位点可抑制拓扑异构酶活性、DNA复制和转录等功能,从而导致细胞癌变。DNA损伤可以改变生物体的遗传信息,引起细胞毒性或遗传毒性。各种研究表明,DNA氧化损伤可诱导单个细胞的程序性死亡、植物生长抑制或死亡、加速衰老以及植物、细菌或动物的癌症[10]。
多项研究表明,提高植物抗氧化防御能力可以有效提高植物的非生物抗逆性。DNA损伤修复(DDR)是植物另一种重要的氧化损伤修复机制。通常,ROS诱导的DNA损伤主要通过碱基切除修复(BER)和核苷酸切除修复(NER)进行修复。DNA错配修复(MMR)、非同源末端连接(NHEJ)和同源重组(HR)也可能参与ROS诱导的DNA损伤的修复,这取决于DNA氧化损伤的类型和结构[11]。各种传感器对DNA损伤的识别是DDR的第一步。细胞周期检查点可以识别DNA损伤信号,然后抑制或阻止细胞周期进程,为DDR提供足够的时间,随后,不同的DNA修复酶被激活以进行DDR。
2. DNA损伤修复机制
DNA损伤信号能够被DNA损伤信号感受器,包括MutS、单链结合蛋白RPA (Replication protein A)复合体和MRN(MRE11-RAD50-NBS1)复合体,识别并传递,从而激活ATM/ ATR激酶,进而调控细胞周期阻滞、细胞内复制、细胞凋亡和DNA损伤修复等生物进程[12]。其中,由DNA MMR家族构成的MutS复合体(包括MutSα,MutSβ和MutSγ)是Cd胁迫引起的DNA损伤信号的主要传感器[13]。其中MutSα(由MSH2和MSH6蛋白构成)和MutSγ(由MSH2和MSH7蛋白构成)主要负责识别DNA序列中1-2个碱基错配,而MutSβ(由MSH2和MSH3蛋白构成)主要识别由2-12个碱基错配修复引起的插入/缺失环[14]。当DNA错配信息被识别后,MutLα(由MLH1和PSM1蛋白构成)被招募,并与结合在DNA链上的MutSα /β /γ 形成临时复合体,并通过PCNA和RFC信号通路启动DNA MMR反应;同时MutLα- MutSα复合体还能够通过ATM/ ATR信号途径启动细胞周期检验点,调控细胞周期相关基因表达和细胞周期进程[15]。
DNA损伤信号引起的细胞周期阻滞,为DNA损伤的修复提供充足的时间,对维护生物体遗传信息的高保真性具有重要意义。另有研究表明,MutSα复合体中的MSH2可直接向ATR传递损伤信号,激活ATR-ATRIP途径[16];MSH2也可以招募DNA修复蛋白和MutLα复合体,并将损伤信号传递并激活ATM;活化后的ATM/ATR激活细胞周期检验点,并通过一系列的信号转导最终激活DNA损伤修复反应。
3.铁在植株生长中的作用
铁元素对植株生长具有极其重要的作用,是植物正常生长和发育不可或缺的微量元素之一。铁元素的缺乏会导致植物出现一系列生长和发育障碍[17]。例如,缺铁会导致叶片出现黄化现象,影响叶片的光合作用和物质生产能力;缺铁还会影响植物根系的发育,导致根系发育不良、生长缓慢等问题;此外,缺铁还会影响植物的开花和结实,导致植物生殖能力下降。
铁是叶绿素合成所必需的微量元素之一。叶绿素是植物进行光合作用的主要色素,负责捕获光能并将其转化为化学能,为植物提供生长所需的能量和物质[18]。铁是多种酶和蛋白的组成部分,参与植物的呼吸作用,如细胞色素氧化酶等。这些酶在呼吸作用中发挥着重要作用,参与能量的产生和转换,为植物的生长和代谢提供必要的能量支持[19]。铁是固氮酶的重要组成成分,对于植物的氮代谢和固氮作用具有重要意义。固氮酶能够将空气中的氮气转化为植物可吸收的氨态氮,为植物提供氮源,促进植物的生长和发育。铁元素还参与植物抗氧化防御系统的构建和运作。铁元素通过参与抗氧化酶的合成和活性调节,帮助植物清除ROS,减轻氧化胁迫对植物的伤害[20]。
与传统的铁肥相比较,EDTA-Fe具有良好的水溶性,性质稳定,可耐高温,不易被氧化可用作微量元素肥料,为植物提供稳定的铁源,有助于预防和解决植物因缺铁而产生的生长问题。同时,EDTA-Fe的吸收率高,生物医学研究表明,其吸收率为硫酸亚铁的2~3倍[21]。但EDTA-Fe在大豆盐碱胁迫响应中的作用及大豆耐盐碱耕作措施中的应用,目前研究尚少。
主要参考文献:
[1] 罗庆云, 於丙军, 刘友良, 2001. 大豆苗期耐盐性鉴定指标的检验.大豆科学, 3:177-182.
[2] 韦存虚, 王建波, 陈义芳, 等, 2004. 盐生植物星星草叶表皮具有泌盐功能的蜡质层. 生态学报, (11): 2451-2456.
[3] Farooq M., Wahid A, Kobayashi N, et al., 2009. Plant drought stress: effects, mechanisms and management. Agronomy for Sustainable Development, 29, 185–212.
[4] Parida AK., Das AB., 2005. Salt tolerance and salinity effects on plants: a review. Ecotoxicology and environmental safety, 60(3): 324-349.
[5] Dmitrieva, N.I., Qi, C. & Burg, M.B. (2004) Cells adapted to high NaCl have many DNA breaks and impaired DNA repair both in cell culture and in vivo. Proceedings of the National Academy of Sciences, 101, 2317–2322.
[6] Daniele, L.B., Gianfranco, T., Francesco, T. & Angela, S. (2010) Traffic air pollution and oxidatively generated DNA damage: can urinary 8-oxo-7,8-dihydro-2-deoxiguanosine be considered a good biomarker? A meta-analysis. Biomarkers: Biochemical Indicators of Exposure, Response, and Susceptibility to Chemicals, 15(6), 538–545.
[7] Bazin, J., Langlade, N., Vincourt, P., Arribat, S., Balzergue, S., El-MaaroufBouteau, H. et al. (2011) Targeted mRNA oxidation regulates sunflower seed dormancy alleviation during dry after-ripening. Plant Cell, 23, 2196–2208.
[8] Dickey, J.S. (2010) Role of oxidatively induced DNA lesions in human pathogenesis. Mutation Research/Reviews in Mutation Research, 704, 152–159.
[9] Scott, T.L., Rangaswamy, S., Wicker, C.A. & Izumi, T. (2013) Repair of oxidative DNA damage and cancer: recent progress in DNA base excision repair. Antioxidants and Redox Signaling, 20(4), 708–726
[10] Seifert, M., Scherer, S.J., Edelmann, W., B?hm, M., Meineke, V., L?brich, M. et al. (2008) The DNA-mismatch repair enzyme hMSH2 modulates UV-B-induced cell cycle arrest and apoptosis in melanoma cells. The Journal of Investigative Dermatology, 128(1), 203–213
[11] D'Errico, M., Parlanti, E., Teson, M., De Jesus, B.M.B., Degan, P., Calcagnile, A. et al. (2014) New functions of XPC in the protection of human skin cells from oxidative damage. EMBO Journal, 25, 4305–4315.
[12] Zhu, JK, 2003. Regulation of ion homeostasis under salt stress[J]. Current opinion in plant biology, 6(5): 441-445.
[13] Wang, H, Cao, Q, Zhao, Q, Arfan, M, et al., 2020. Mechanisms used by DNA MMR system to cope with Cadmium-induced DNA damage in plants[J]. Chemosphere, 246.
[14] Lloyd, AH, Milligan, AS, Langridge, P, et al., 2007. TaMSH7: A cereal mismatch repair gene that affects fertility in transgenic barley (Hordeum vulgare L.)[J]. BMC Plant Biology, 7(1): 67.
[15] Marina, Elez, Miroslav, Radman, Ivan, Matic, 2012. Stoichiometry of MutS and MutL at unrepaired mismatches in vivo suggests a mechanism of repair[J]. Nucleic Acids Research, 40(9): 3929-3938.
[16] Edelbrock M A , Kaliyaperumal S , Williams K J, 2013. Structural, molecular and cellular functions of MSH2 and MSH6 during DNA mismatch repair, damage signaling and other noncanonical activities[J]. Mutation research, 13, 743:53-66.
[17] 梁志君.锌铁胁迫对水稻生长的影响及籽粒累积锌铁差异的研究[D].华中农业大学,2016.
[18] 贾凤芹.喷施铁肥对葡萄、桃叶片光合特性和果实品质的影响[D].河南科技学院,2023.
[19] 侍朋宝.铁对酿酒葡萄果实风味物质及类黄酮合成相关基因表达的影响[D].西北农林科技大学,2017.
[20] 丁申.铁和谷胱甘肽对杨树积累镉的生理与分子调控机制研究[D].西北农林科技大学,2019.
[21] 李思慧.EDTA-Fe插层水滑石UV-Fenton降解偶氮胭脂红B的研究[D].湘潭大学,2016.