已在校内实验室实习一年??,熟知病原检测及实验操作流程。
1.省自然科学基金项目:布鲁氏菌病抗体(鉴别)时间分辨荧光免疫层析检测方法的建立,2019.06—2022.06。
2.黑龙江省农垦总局项目:猪瘟病毒与非洲猪瘟病毒双重荧光PCR检测方法的建立,2019.01—2021.12。
3.横向课题:生猪动物疫病防控,2020.05—2023.04。
已在校内实验室实习一年??,熟知病原检测及实验操作流程。
1.省自然科学基金项目:布鲁氏菌病抗体(鉴别)时间分辨荧光免疫层析检测方法的建立,2019.06—2022.06。
2.黑龙江省农垦总局项目:猪瘟病毒与非洲猪瘟病毒双重荧光PCR检测方法的建立,2019.01—2021.12。
3.横向课题:生猪动物疫病防控,2020.05—2023.04。
| 序号 | 学生 | 所属学院 | 专业 | 年级 | 项目中的分工 | 成员类型 |
|---|---|---|---|---|---|---|
|
|
赵小锐 | 动物科技学院 | 动物医学(创新人才班) | 2021 | 项目设计与研发 |
|
|
|
王红 | 动物科技学院 | 动物医学(创新人才班) | 2021 | 资料收集 |
|
|
|
刘洋 | 动物科技学院 | 动物医学(创新人才班) | 2021 | 阅读文献 |
|
|
|
郑纪伟 | 动物科技学院 | 动物医学(创新人才班) | 2021 | 资料整合概括 |
|
|
|
韩坤 | 动物科技学院 | 动物医学(创新人才班) | 2021 | 参与研发 |
|
| 序号 | 教师姓名 | 所属学院 | 是否企业导师 | 教师类型 |
|---|---|---|---|---|
|
|
王金涛 | 动物科技学院 | 否 |
|
PEDV、TGEV、PoRV是临床上引起仔猪腹泻病的3种主要病毒。这三种病毒持续危害着整个养猪业,给我国造成了严重的经济损失。由于3种病毒的临床症状和病理变化非常相似,仅靠临床诊断很难区分病原,需要借助实验室方法检测。PEDV目前存在经典毒株与变异毒株,现如今PEDV经典疫苗株作为弱毒疫苗被广泛使用。PEDV经典疫苗株ORF3基因较强毒株存在缺失,利用二者区别设计引物,特异性扩增强毒ORF3基因保守序列而不扩增弱毒ORF3基因保守序列,可区别经典疫苗株,避免养殖户对PEDV感染情况作出错误判断。基于此,本研究根据拟建立的PEDV、TGEV和PoRV三重RT-PCR方法,可以准确的检测PEDV、TGEV和PoRV三种病毒并在此基础之上区分PEDV经典疫苗株。
1.
单重RT-PCR方法的建立
1.1 引物合成与验证
利用mega
7.0.26比对NCBI上公布的PEDV、TGEV和PoRV流行毒株基因序列,利用primer 5.0根据其保守区域设计特异性引物。提取PEDV经典强毒株CV777、及其致弱毒株、TGEV弱毒华株、PoRV NX株病毒核酸,反转录为cDNA,作为模板验证引物效果。
1.2 标准品制备
根据引物扩增基因,由上海生工生物工程公司合成标准质粒。
1.3 反应条件优化
根据引物Tm值设置梯度退火温度,设置梯度引物浓度、梯度循环数和反应酶添加量,对标准质粒进行PCR扩增,通过琼脂糖凝胶电泳进行验证,选择最亮条带的反应条件作为三重RT-PCR条件参考。
2. 三重RT-PCR方法的建立与评价
2.1 反应条件优化
等比例混合PEDV、TGEV和PoRV标准质粒,通过RT-PCR优化反应条件,具体优化模式参考1.3,明确三重RT-PCR最佳反应条件。
2.2 敏感性
等比例混合PEDV、TGEV和PoRV标准质粒,10倍梯度稀释混合的标准质粒,利用建立的三重RT-PCR检测方法检测每一个稀释倍数的混合质粒,取三种病毒核酸条带均能清晰辨认的质粒浓度为该方法最低检出限。
2.3 特异性
利用建立的三重RT-PCR检测方法同时检测PEDV、TGEV、PoRV、猪呼吸与繁殖综合征病毒、猪伪狂犬病毒、猪细小病毒、经典猪瘟病毒和猪圆环病毒2型等导致猪腹泻的病毒。
2.4 稳定性
利用建立的三重RT-PCR检测方法重复多次检测同一标准质粒和阴性样本,确定方法的稳定性。
3. 临床检测
3.1 样品采集与检测
采集1-10日龄腹泻仔猪新鲜粪便,经PBS涡旋震荡重悬,离心后取上清液,提取总RNA并反转录为cDNA。利用建立的三重RT-PCR检测方法对cDNA进行检测,确认样本中PEDV、TGEV和PoRV阳性率。
3.2 符合性试验
利用建立的三重RT-PCR检测方法分别与权威单重RT-PCR检测方法以及其他PEDV、TGEV和PoRV三重检测方法检测临床阳性和阴性样本,进行对比。扩增差异条带并测序,验证差异结果,明确检测方法符合性。
猪流行性腹泻的病原为PEDV,为单链正义RNA病毒,隶属于冠状病毒,α科冠状病毒属[1],主要通过消化道感染猪肠道,导致仔猪腹泻、脱水和死亡,也可感染成年猪导致腹泻,死亡率可达100%[2]。PEDV于1971年在英国被发现,随后陆续在欧洲各国流行并迅速传至世界各地[3]。1980年,PEDV首次传入中国。2010年,由于PEDV变异毒株的出现导致了中国大量仔猪的死亡[4]。由此,PEDV被分为GⅠ型经典毒株和GⅡ型变异毒株[2]。由于PEDV经典弱毒株作为疫苗被广泛应用,但其不能预防PEDV变异毒株的感染,无法区分PEDV经典疫苗株和变异株导致难以正确判断疫情。
猪传染性胃肠炎的病原为TGEV,为单链正义RNA病毒,隶属于冠状病毒科,α冠状病毒属[5]。主要通过粪口传播感染仔猪,可导致仔猪出现呕吐、腹泻和严重脱水[6]。 TGEV自1946年在美国被报道,之后陆续传播至欧洲和亚洲[7]。TGEV N基因保守性高且蛋白含量最为丰富[8],适合作为RT-PCR检测靶标。根据TGEV N基因设计的PCR检测引物应具有较好的保守性。
PoRV为分节段的双链RNA病毒,隶属于呼肠孤病毒科,轮状病毒属[9]。各年龄段的猪均可感染该病毒,主要症状为水样腹泻、呕吐等,尤其是仔猪感染症状最严重,虽然死亡率较其他两种病原低,但发病率高达100%,严重影响仔猪生长性能[10]。1975年首次在猪体内发现轮状病毒,随后PoRV在世界各地广泛流行。轮状病毒基因组包含11个节段,分别编码6个结构蛋白和5个非结构蛋白[11]。,其基因组由11个独立片段的双股正链RNA组成 ,共编码6种结构蛋白 (VP1~VP4、VP6和 VP7)和6种非结构蛋白 (NSP1~NSP6),其中第11节段编码 NSP5和 NSP6两种非结构蛋白[12]。其根据VP6氨基酸序列差异可划分为A~J 10个群,其中A、B、C和H群与仔猪腹泻密切相关,其中A群轮状病毒(RVA)的致病性相对较高且流行最广,而轮状病毒VP6基因高度保守[13],适合作为RT-PCR检测靶标。这三种病毒在中国大量流行,严重影响生猪养殖业的发展。
PCR检测方法以其高敏感性、特异性和稳定性,被广泛运用于分子生物学检测一线。国内目前存在多种同时检测PEDV、TGEV和PoRV的多重PCR检测方法,李儒曙[14]等建立了基于Taq Man探针的PEDV、TGEV、PoRV三重RT?PCR检测方法,但是样本检测成本高,且以PEDV N基因为检测靶标难以区分经典疫苗株。蒲翠敏[15]等建立了PEDV、TGEV和PoRV三重PCR检测方法,分别靶向PEDV S基因、TGEV M基因和PoRV VP7基因,但是由于PEDV S基因和PoRV VP7基因易突变,容易导致检测结果假阴性。同时也缺少区别PEDV 经典疫苗株的能力。综上,需要研发一种适合基层检测、检测结果稳定,同时具备一定PEDV经典疫苗株分辨能力的多重PCR检测方法。
参考文献:
[1] 李公美, 李茂辉, 钱爱东, 等.猪流行性腹泻病毒新型检测方法的研究进展[J].中国兽医学报, 2020,
40(3): 650-653.
[2] ung
K, Saif L J, Wang Q. Porcine epidemic diarrhea virus (PEDV): An update on
etiology, transmission, pathogenesis, and prevention and control[J]. Virus Res,
2020, 286: 198045.
[3] 刘维哲. PEDV四川株(CHN-SC2021)的分商鉴定及N蛋白单克隆抗体的制备 [D].
2023.
[4]
Wang D, Fang L, Xiao S. Porcine epidemic diarrhea in China [J]. Virus Res,
2016, 226: 7-13.
[5] 李训良.猪传染性胃肠炎病毒的分子生物学研究进展[J].畜禽业,2017,28(05):5-6.
[6] Yuan
D, Yan Z, Li M, et al. Isolation and Characterization of a Porcine
Transmissible Gastroenteritis Coronavirus in Northeast China[J]. Front Vet Sci,
2021, 8: 611721.
[7]
Alonso S, Izeta A, Sola I, et al. Transcription regulatory sequences and mRNA
expression levels in the coronavirus transmissible gastroenteritis virus[J]. J
Virol, 2002, 76(3): 293-308.
[8] 董珮玲. 猪传染性胃肠炎病毒N蛋白单克隆抗体的制备及其初步应用[D]. 华中农业大学, 2023.
[9] 王红涛, 王丕武. 重组猪轮状病毒VP7表达载体的构建与免疫原性分析[J]. 农业生物技术学报, 2020, 28(12): 2221-2229.
[10]
Marthaler D, Suzuki T, Rossow K,et al. VP6 genetic diversity,reassortment,intragenic
recombination and classification of rotavirus B in American and Japanese pigs
[J]. Veterinary Microbiology, 172(3-4): 359-366.
[11] 郝妍. 轮状病毒VP7及NSP4蛋白适应性进化研究[D]. 2008.
[12]
KOMOTO S,KANAI Y,FUKUDA S,et al.
Reverse genet-ics system demonstrates that rotavirus nonstructural proteinNSP6
is not essential for viral replication in cell culture[J]
[13] 王小奎.猪轮状病毒VP4亚单位疫苗的制备及免疫原 性分析[D]. 2021.
[14] 李儒曙, 苏惠龙, 蒋郁明, 等.基于Taqman探针三重Real-Time
RT-PCR检测PEDV、TGEV、PoRV方法的建立与应用[J]. 广东畜牧兽医科技, 2019,
44(05):41-44.
[15] 蒲翠敏, 冯旭芳, 张双翔, 等.PEDV、TGEV和PoRV三重PCR检测方法的建立及初步应用[J]. 动物医学进展, 2018, 39(02):19-25.
本项目创新点和特色之处在于靶向PEDV、TGEV和PoRV 保守基因设计特异性引物,可特异性识别样本中PEDV、TGEV和PoRV,并且由于PEDV检测引物的设计基于PEDV强毒株与经典疫苗株ORF3基因差异序列,可特异性检测PEDV强毒株却不扩增经典疫苗株ORF3序列,可鉴别PEDV经典疫苗株。
技术路线
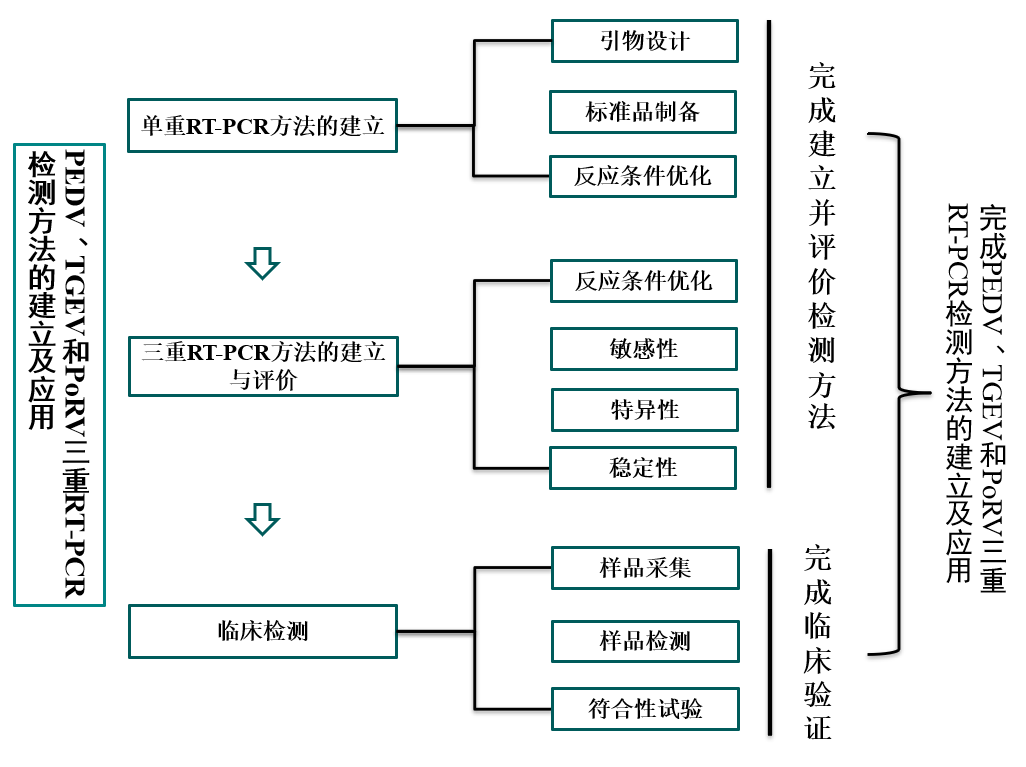 技术路线
技术路线
拟解决问题
建立PEDV、TGEV和PoRV三重RT-PCR检测方法,同时完成样本PEDV、TGEV和PoRV病原检测,区分PEDV经典疫苗株。
预期成果
1.
完成建立PEDV、TGEV和PoRV三重RT-PCR方法,产品可以临床用于检测PEDV、TGEV和PoRV三种病毒并在此基础之上区分PEDV经典疫苗株。
2.
发表论文一篇或申请专利一项。
3.
参加竞赛一项。
2024年 09月~2024 年12月:完成实验设计,准备实验试剂。
2025年 01月~2025年09月:优化RT-PCR反应条件,尽可能多的临床检测样本,整理实验记录。
2025年10月~2025年12月:撰写文章和结题报告。
已完成PEDV、TGEV和PoRV流行毒株序列比对并设计相关引物。
本项研究依托黑龙江八一农垦大学动物科技学院动物分子病原与疫苗创制实验室,实验室具备进行PEDV、TGEV和PoRV三重RT-PCR检测方法建立所需要的必要仪器、设备、试剂与场所,实验室具备三重RT-PCR检测方法建立的经验,可以保证项目正常完成。目前缺少临床检测样本。
解决方法:已经联系多所生猪养殖场,可进行腹泻仔猪粪便样本的采集。
| 开支科目 | 预算经费(元) | 主要用途 | 阶段下达经费计划(元) | |
|---|---|---|---|---|
| 前半阶段 | 后半阶段 | |||
| 预算经费总额 | 10000.00 | 无 | 8000.00 | 2000.00 |
| 1. 业务费 | 5000.00 | 无 | 3000.00 | 2000.00 |
| (1)计算、分析、测试费 | 3000.00 | 检测费 | 3000.00 | 0.00 |
| (2)能源动力费 | 0.00 | 无 | 0.00 | 0.00 |
| (3)会议、差旅费 | 0.00 | 无 | 0.00 | 0.00 |
| (4)文献检索费 | 0.00 | 无 | 0.00 | 0.00 |
| (5)论文出版费 | 2000.00 | 论文版面费 | 0.00 | 2000.00 |
| 2. 仪器设备购置费 | 0.00 | 无 | 0.00 | 0.00 |
| 3. 实验装置试制费 | 0.00 | 无 | 0.00 | 0.00 |
| 4. 材料费 | 5000.00 | 试剂耗材 | 5000.00 | 0.00 |